Determinaciones de actividad biologica para evidenciar diferencias entre manejos agricolas
Publicado el: 05/11/2014
Autor/es:
Marcela Cossoli;
Gómez, F.E.; Ojeda, F.N.; Toledo, S.; Villar Ramirez, N.E.; Iglesias,
M.C (Cát. de Microbiología Agrícola- Fac. de Ciencias. Agrarias-UNNE);
Romagnoli, J.C.J. (Grupo Romagnoli)
INTRODUCCIÓN
La calidad del suelo no es fácil de
conceptualizar, ya que la misma se define en función al uso y manejo del
medio edáfico que favorece determinadas condiciones (suelos agrícolas,
forestales, industriales, urbanos); no obstante, debe de tomar en cuenta
el equilibrio medio ambiental y las funciones básicas del suelo:
infiltrabilidad, productividad y degradación (Doran et al. 1994). Entre
otras, las actividades agropecuarias son las que se encuentran
mayormente vinculadas a situaciones de degradación de suelos por
diferentes causas; entre las cuales el sobrepastoreo animal, la
deforestación y el agotamiento de nutrientes por inadecuadas prácticas
agrícolas como un mal uso o ausencia de la rotación de cultivos
adquieren mayor significación. Desde el punto de vista biológico, se lo
considera al suelo como un organismo viviente ya que alberga una gran
cantidad y diversidad de organismos vivos. Estos son los responsables de
la actividad biológica del suelo. Así, los parámetros microbiológicos
aportan información relativa a la actividad metabólica que se halla en
el suelo, pues son muy sensibles a variaciones del medio. Además,
mantienen una mayor sostenibilidad frente a procesos no deseables como
la contaminación o el mal manejo. Es por ello que los efectos de
prácticas agrícolas, como los efectos de los agroquímicos y sistemas de
cultivo pueden ser evaluados a partir de las determinaciones de biomasa
microbiana, su actividad metabólica y conteo de poblaciones microbianas
más importantes de la microflora del suelo. La correcta interpretación
de los resultados depende de lo bien que sean interpretados los
indicadores con relación a uso de las tierras y objetivos ecológicos.
El objetivo de este trabajo fue
evidenciar diferencias que puedan existir en relación a factores
incidentes referidos a manejos de sistemas agrícolas, mediante
mediciones de actividad biológica y presencia de ciertos microorganimos.
MATERIALES Y MÉTODOS
Para la evaluación, se trabajó con muestras provenientes de un ensayo instalado en la localidad de Monte Buey (Córdoba), cuyo diseño es con estructura factorial de tratamientos, el mismo considera tres factores con dos niveles cada uno:
1) Fertilización: Sin Fertilización (F1) y Máxima Fertilización (F2)
2) Siembra Directa: Siembra directa interrumpida (SD1) y Siembra directa continuada (SD2).
3) Rotación: Rotación estándar (R1) y Rotación Intensiva (R2).
De esta forma con la combinación de estos factores y sus niveles quedaron definidos 8 tratamientos.
En el trabajo se incluyen las determinaciones a partir de un muestreo realizado en Febrero de 2012, destacándose la gran sequía en la región al momento del mismo.
Para evidenciar el efecto de los tratamientos generados en las diferentes parcelas se realizaron una serie de determinaciones.
Al momento del muestreo, en cada parcela, se tomó una cantidad
conocida del material vegetal que cubría la superficie, pudiendo
determinar de esta forma los Kg.ha-1 de cobertura.
Una vez que las muestras llegaron al laboratorio, se realizó la
determinación de la humedad al momento del muestreo, por gravimetría a
40 ºC, hasta peso constante y color uniforme de la muestra, el resultado
se expresó en %.
Se midieron diferentes procesos que hacen a la actividad biológica del suelo, para eso se realizaron determinaciones de:
- Actividad respiratoria y actividad amonificante: se midió por
retrovaloración la captación de CO2 en solución alcalina para la primera
y de NH3 en solución ácida para la segunda, ambas en incubaciones
aeróbicas (Ohlinger, 1996; Frioni 2011).
- Actividad celulolítica en placas de suelo: se midió la
degradación de microdiscos de celulosa en laboratorio, expresándola en
%, a los 7, 14, 21 y 28 días de incubación (Winogradsky,1949, Quant
Bermúdez & Bakos, 1984).
- Actividad celulolítica a campo: mediante la utilización de redes
con placas de material celulósico “litter bag” que fueron enterradas en
las diferentes parcelas y retiradas a los 40 días, se expresó en % de
degradación (Van Wesemael, 1993).
Por otro lado se determinó la presencia de grupos microbianos, que
llevan adelante diferentes funciones en lo que hace a la relación con
las plantas, estos fueron:
- Presencia de fijadores libres: se determinó la aparición de
colonias morfotípicas tipo Azotobacter, mediante la técnica ecológica de
la placa de suelo moldeado con medio de cultivo sin nitrógeno
(Winogradsky, 1949).
- Presencia de micorrizas nativas: se determinó el % de infección
micorrícica en raíces de pepino, que se utilizó como planta trampa.
- Presencia de rizobios naturalizados: se cuantificó la nodulación
en raíces de soja que se utilizó como planta trampa (Frioni, 2011).
Los datos fueron tabulados y analizados en el programa INFOSTAT (Di Rienzo et al., 2011), mediante ANAVA, con prueba de Tukey (p≤0.05) para la comprobación de medias. Estas comparaciones se realizaron teniendo en cuenta la influencia de cada factor por separado y además se analizaron todas las interacciones posibles entre ellos y su significancia. Por otro lado se realizó un análisis multivariado discriminante para evidenciar las diferencias existentes entre las parcelas analizadas en relación a los factores incidentes.
RESULTADOS Y DISCUSIÓN
La Tabla 1 refleja el análisis de varianza realizado en cada una de las variables determinadas, allí se muestran la influencia significativa de cada uno de los factores individualmente y las interacciones significativas que pudieron existir, entre estos.
En relación a la cobertura al momento del muestreo se observó la
influencia significativa de los años de siembra directa, siendo un 69 %
mayor el tratamiento con más años con respecto a la siembra directa
interrumpida, en el caso de fertilidad la diferencia significativa fue a
favor del de máxima fertilidad con un 17 % mayor que el de mínima
fertilidad. La interacción significativa se dio entre siembra directa y
rotación, destacándose la combinación SD2*R2.
Tabla 1. Significancia sobre las variables analizadas, de cada factor estudiado en forma individual, y sus interacciones.
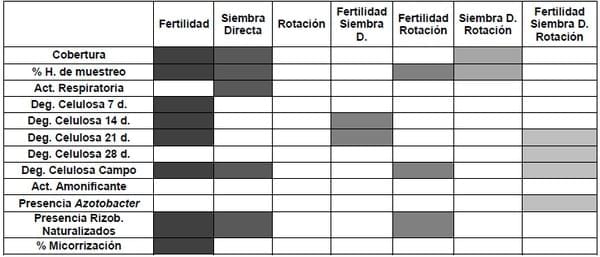
Con respecto a la humedad del suelo, si bien los valores en general
fueron bajos (entre 1 y 2,5 %), al analizar se observa que el factor
fertilidad y siembra directa afectaron significativamente en forma
individual, habiendo mayor contenido en los tratamientos de mayor
fertilidad y más años de siembra directa, no así en conjunto, pero sí lo
hicieron cuando se evaluó la interacción de ambos factores por separado
con rotación, siendo mayores las combinaciones de rotación intensiva
con máxima fertilidad por un lado y más años de siembra directa por
otro.
En relación a la actividad biológica, en el caso de la respiración
medida, se pudo observar que el factor siembra directa fue el que tuvo
un efecto significativo, siendo mayor el SD2 aunque no fue significativa
la interacción, también fue superior este parámetro cuando se combinó
con máxima fertilidad. Coincidiendo con datos obtenidos por Omay et al.
(1997), donde también tuvieron mayor mineralización de carbono en
situaciones con alta fertilidad y al igual que ellos no encontramos
influencia de la rotación en este parámetro
Analizando la actividad celulolítica, determinada en laboratorio, el comportamiento de este parámetro fue cambiando a lo largo de los días de incubación y fue influenciado en forma gradual por diferentes factores, de esta forma tenemos que en la medición de los 7 días influyó significativamente la fertilidad siendo casi 4 veces mayor la situación de mayor fertilidad con respecto a la de menor fertilidad, probablemente influenciado por un mayor contenido nutricional que influyó en el inicio del proceso. Cuando se realizó la medición a los 14 día de incubación, además de la influencia significativa de la fertilidad, también lo fue la interacción con siembra directa, destacándose la combinación F2*SD2. Luego, en la medición de los 21 días, se plantea la misma situación anterior agregándose la interacción significativa, ya de los tres factores, siendo la combinación F2*SD2*R1 la destacada y por último en la medición a los 28 días de incubación, fue solo significativa la interacción de los tres factores.
En relación a este mismo proceso medido en la situación real de campo, se destacó la influencia del factor fertilidad y siembra directa siendo las situaciones de máxima, las destacadas. Esta variable fue una de las pocas donde hubo interacción de fertilidad con rotación, también interactuaron los tres factores significativamente.
En el caso de la medición de actividad amonificante, los análisis de varianza no mostraron diferencias significativas en la influencia de los factores por separado y tampoco en ninguna de las interacciones posibles.
En relación a las determinaciones de presencia de ciertos microorganismos o grupos microbianos se puede observar que en el caso de fijadores libres de nitrógeno, tipo Azotobacter, su presencia significativa, medida como número de colonias, estuvo ligada a la interacción de los tres factores.
La infección micorrícica por parte de hongos nativos del suelo estuvo influenciada por la fertilidad, siendo mayor en las situación de fertilidad mínima, esto coincide con la idea de que a mayor disponibilidad de nutrientes en el suelo, menor puede llegar a ser la formación de micorrizas (Cardoso et al., 2010)
Analizando la nodulación en plantas de sojas por parte de rizobios naturalizados, se pudo observar la influencia significativa de la fertilidad y de siembra directa, al igual que la infección de hongos micorrícicos, la nodulación fue significativamente mayor en la situación de menor fertilidad y en este caso esta situación también se dio en el tratamientos SD1, existió interacción que entre el primer factor y la rotación, siendo mayor la nodulación en la situación F1*R1, esta situación parece lógica teniendo en cuenta la alta fertilidad puede inhibir muchas en ciertos casos la fijación biológica del nitrógeno (Frioni, 2011).
Analizando estos datos en conjunto se observa que predominó la
influencia del factor fertilidad en el comportamiento de las diferentes
variables, seguido por siembra directa y sin influencia significativa,
al menos de la rotación, con respecto a las interacciones, predomino
la influencia de fertilidad*rotación y de los tres factores en conjunto.
También se pudo observar que en ninguna variable influyó significativamente en forma individual el factor Rotación.
Se realizó un análisis que incluyó todas estas variables y demostró
aún más la capacidad de diferenciar comportamientos según la influencia
de estos factores, es así que con un análisis multivariado
discriminante, esta situación que surge de ver la tabla de
significancias, se reforzó.
En la Figura 1, teniendo en cuenta el factor Fertilidad, claramente
se dividen los dos niveles del mismo, de esta forma se puede evidenciar
las diferencias entre las parcelas asociadas a este factor.
En la Figura 2, se observa que el factor Siembra Directa también
logra exaltar diferencias, cuando se tienen en cuenta todas las
variables medidas, los dos niveles de este factor quedan bien
diferenciados.
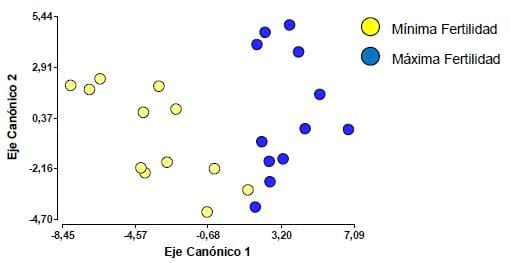
Figura 1. Análisis discriminante teniendo en cuenta el factor Fertilidad
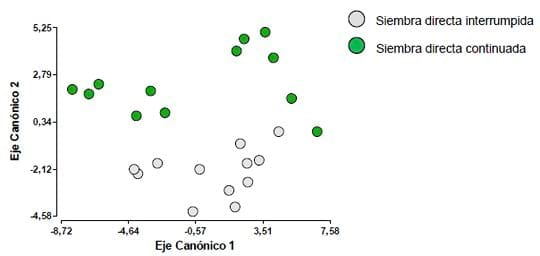
Figura 2. Análisis discriminante teniendo en cuenta el factor Siembra Directa
Cuando este tipo de análisis se hizo teniendo en cuenta el factor
Rotación (Figura 3), no se lograron separar de forma tan clara ambos
niveles, esta situación refuerza lo que se había observado con respecto a
este factor en la Tabla 1.
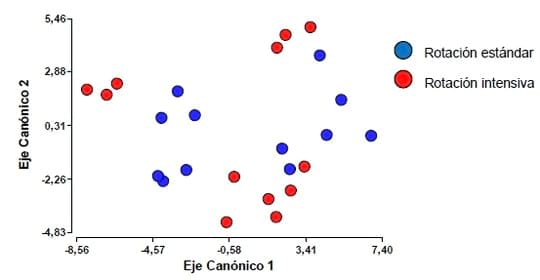
Figura 3. Análisis discriminante teniendo en cuenta el factor Rotación
CONCLUSIÓN
Teniendo en cuenta todas las variables medidas, que reflejaron la actividad y presencia de los microrganismos, se pudieron evidenciar diferencias que estuvieron asociadas a factores relacionados a prácticas culturales de sistemas agrícolas.
BIBLIOGRAFÍA
Cardoso, EJBN; IM Cardoso; MA Nogueira; CRD Maluche Baretta; A.M. De Paula. 2010. Micorrizas arbusculares na aquisição de nutrientes pelas plantas. E: Micorrizas: 30 anos de pesquisas no Brasil. Siqueira EO; FA de Souza; EJBN Cardoso; S Mui Tsai. Ed. UFLA, 716 p.
Doran, JW; TB Parkin.1994. Defining and assensing soil quality. In: Defining Soil Quality for a Sustainable Environment. SSSA. Special Publication no. 35.
Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada; CW Robledo. InfoStat versión 2011. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar
Frioni L., 2011. Microbiología: básica, ambiental y agrícola. 1ª ed. Orientación Grafica Editora. Buenos Aires.
Omay, AB; CW Rice; LD Maddux & WB
Gordon. 1997. Changes in soil microbial and chemical properties under
long-term crop rotation and fertilization. Soil Sci. Soc. Am. J.
61:1672-1678.
Winogradsky, S. 1949. Microbiologie du
sol. Problemes et methodes. Cinqunante ans recherches. Masson Et Cie
Editeurs. Boulevard Saint-Germain-Paris, 861 pp.
Quant Bermúdez, F. J.; & Bakos, B.
(1984). Empleo de microdiscos de papel de filtro para la evaluación de
celulòlisis en placa de tierra. Pub. Técnica, (1).
Van Wesemael, B. 1993. Litter
desconposition and nutrient distribution in humus profiles in some
mediterranean forest in southern Tuscany. Forest Ecology and Management
57 (1993): 99-114.
Autor/es